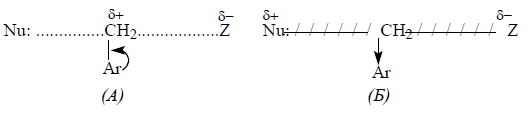Фенильные заместители
Незамещенные в кольце первичные бензильные соединения реагируют быстрее вторичных алкильных субстратов.
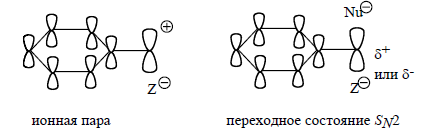
Фенильный заместитель способен стабилизировать как бензильный карбокатион в составе контактной ионной пары, так и переходное состояние $SN2$. Знак частичного заряда, возникающий на бензильном атоме углерода в переходном состоянии, на стабилизацию не влияет.
Рисунок 1.
В число наиболее эффективных уходящих групп входят: $Br^-$, $Cl^-$, $SO_3^{2-}$, $N^{2-}$ и т.д.
Для соответствующих бензильных субстратов наблюдаются процессы, подобные нуклеофильному замещению у насыщенного углеродного атома.
Например: Замещение $N_2$ в реакциях с солями диазония $ArN^{2+}.$
$ArN_{2+} + Y^- → ArY + N_2$
Скорость реакции не зависит от концентрации $Y^-$, что соответствует медленному образованию арил – катиона с последующей быстрой реакцией с нуклеофилом.
Добавленные нуклеофилы ($MeOH$, $Cl$ и др.) оказывают влияние на состав продуктов реакции.
Образование неустойчивого фенил – катиона происходит благодаря эффективности азота как уходящей группы. В ходе этой реакции в растворе могут образовываться простые арил – катионы, характеризующиеся высокой реакционной способностью и малой избирательностью по отношению к нуклеофилам.
Влияние заместителей в бензольном кольце на скорость реакции
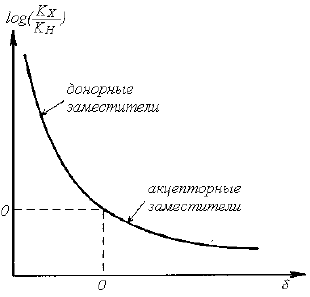
Для первичных бензильных соединений характерными являются нелинейные гамметовские зависимости.
Рисунок 2.
Гамметовская зависимость для сольволиза соединения $ArCH_2Z$
Эта зависимость отличается тем, что донорные заместители ($n-OR$, $n-CH_3$, $n-OCH_3$, $SR$, $NHAc$ и др.) гораздо больше ускоряют сольволиз, чем это вытекает из величин констант заместителей $σ$.
Например, гамметовские зависимости характерны для следующих реакций:
$ArCH_2OTs + CH_3COOH → ArCH_2OCOCH_3 + TsOH$
$ArCH_2Cl + Ar`NH_2 → ArCH_2NHAr` + HCl$
Если в бензольном кольце $XC_6H_4CH_2Z$ поменять заместитель, то это даст нелинейную гамметовскую зависимость. Изменение в соединении $Ar`NH_2$ даст линейную зависимость. Однако наклон кривой ($ρ$) зависит от заместителя в бензильном субстрате.
Для $n-CH_3OC_6H_4CH_2Cl$ $ρ=-0,59$, а для $n-NO_2C_6H_4CH_2Cl$ $ρ=-1,55.$
Существует два подхода объяснения, почему гамметовская зависимость может быть вогнута с верхней стороны:
- Механизм реакции будет меняться при переходе от $SN2$ к $SN1$в результате перехода от акцепторных заместителей к донорным. Если у заместителей среднее значение σ, то субстрат реагирует по направлению и $SN2$ и $SN1$, то есть процесс идет по двум параллельным путям.
- Механизм реакции может не меняться при переходе от акцепторных заместителей к донорным, но происходит постепенное изменение структуры переходного состояния. Например: Электронодонорные заместители способствуют появлению «рыхлого» переходного состояния (А), проявляющего существенные карбокатионные свойства. Напротив, электроноакцепторные группы притягивают нуклеофил, способствуя образованию «тесного» переходного состояния (Б):
Рисунок 3.
Влияние заместителей в нуклеофиле для донорных арильных групп проявляется меньше, чем для акцепторных
Наиболее типичной реакцией нуклеофильного замещения является замещение галогенид – иона в галогенпроизводном, активированном электроноакцепторными группами соединении. Для этих реакций характерно формальное сходство с $SN2$-механизмом.
Влияние нуклеофила на структуру переходного состояния
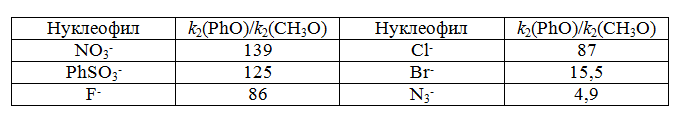
Рассмотрим реакционную способность пара-феноксибензилхлорида и пара-метоксибензилхлорида в 70% водном растворе ацетона при 20ºС.
Если нуклеофилы отсутствуют, реакция гидролиза идет по $SN1$-механизму (с образованием сольватно – разделенной ионной пары). Для этой реакции отношение констант первого порядка составляет $k_1(PhO)/k_1(MeO)=135.$ При добавлении нуклеофилов ($SN1$-механизм) данное соотношение изменится:
Рисунок 4.
Наиболее сильным из представленных будет нуклеофил $N_3^-$. Он предопределяет «тесное» переходное состояние, характеризующееся слабым растяжением связи $C-Cl$, небольшим зарядом на бензильном углеродном атоме, незначительной зависимостью скорости реакции от заместителя в арильной группе.
Более слабые нуклеофилы ($PhSO_3^-$, $NO_3^-$) способствуют образованию более «рыхлого» переходного состояния, имеющего весомый положительный заряд на углеродном атоме.
Переход от SN2 к SN1-механизму
Постепенное изменение механизма нуклеофильного замещения от $SN2$ к $SN1$-механизму возможно при изменении
- структуры субстрата;
- природы нуклеофила;
- природы уходящей группы.
При увеличении стабильности карбокатиона и уменьшении силы нуклеофила происходит переход от $SN2$-механизма сначала к $SN1$-механизму (контактно – ионные пары), а затем к $SN1$-механизму (сольватно – разделительные ионные пары).
Иногда возможно параллельный ход реакций по механизмам: $SN1$(И) и $SN1$(СИП) или $SN2$ и $SN1$(КИП).